不同公司的RNasin产品性能的对比
一、实验目的:
通过RT-PCR实验,对宝生物(Takara)和新景生物的RNasin产品的性能效果进行对比。
二、实验材料及设备:
Fast 1st strand cDNA Synthesis Kit(with gDNase)(simgen)、
水浴锅(XMTD-6000,上海宜昌仪器纱筛厂)、
离心机(5452,德国eppendorf股份公司)、
ABI PRISM®7000荧光PCR仪(7000,美国ABI公司)、
漩涡振荡仪(XH-C,金坛市医疗仪器厂)。
三、实验方法:
设计:
编号 | RNA | RNase | RNasin |
T1 | 1μg | 2ng | 40U(Takara) |
T2 | 1μg | 4ng | 40U(Takara) |
T3 | 1μg | 8ng | 40U(Takara) |
T4 | 1μg | 16ng | 40U(Takara) |
S1 | 1μg | 2ng | 40U(Simgen) |
S2 | 1μg | 4ng | 40U(Simgen) |
S3 | 1μg | 8ng | 40U(Simgen) |
S4 | 1μg | 16ng | 40U(Simgen) |
四、实验步骤:
1.RNA提取
按照Trizol 柱纯化总RNA试剂盒(simgen)说明书操作提取RNA,用50 μl RNase-free水洗脱。
2.RNasin抑制RNase反应
按下表配置反应体系:
组分 | 使用量 |
5×g Buffer | 2 μl |
RNA | 1 μg |
RNasin | 40 U |
RNase | X ng |
RNase-free H2O | 补至10 μl |
注:为是RNasin与RNase充分结合,所以需将RNasin和RNase先混合在一起;为使其他组分均匀,所以应多管一起配置,混匀后再分装至各管,如配置10管量时:
组分 | 10管使用量 |
5×g Buffer | 20 μl |
RNA | 10 μg |
RNase-free H2O | 补至70 μl |
每管分装7μl,然后在将混合后的RNasin和RNase混合加入,补RNase-free H2O至10μl,混匀。37℃30min使RNase反应,4℃保存待用。
3.cDNA合成
按Fast 1st strand cDNA Synthesis Kit(with gDNase)(simgen)说明书操作。
4.荧光PCR检测
按2×SYBR Green PCR Mix(simgen)说明书操作。
五、实验结果:
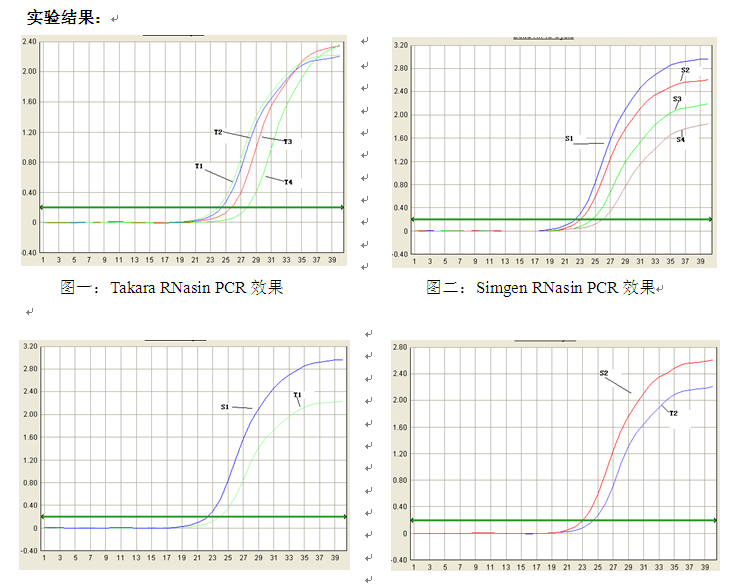
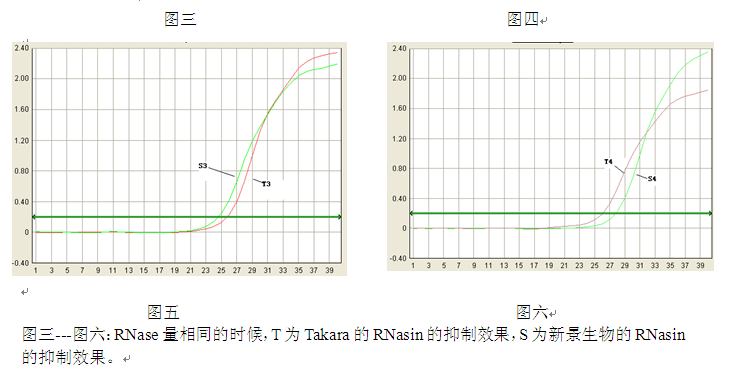
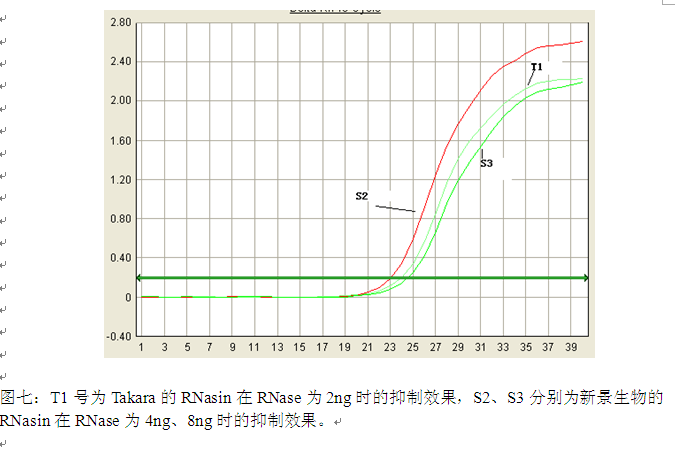
六、讨论与分析:
1.从图一、图二中可看出,当RNase的量增多时,cDNA的起始浓度会降低,说明RNasin只对一部分量的RNase产生抑制。未抑制的RNase仍会对RNA产生影响;
2.从图三到图六可以看出,在相同量的RNase和RNasin情况下,不同公司RNasin对RNase的抑制效果是不同的,新景生物的RNasin抑制RNase活性的效果比Takara生物的RNasin的抑制RNase活性的效果好;
3.从图七可以看出,在相同RNasin的量下,新景生物的RNasin对4ngRNase的抑制效果比Takara生物的RNasin对2ngRNase的抑制效果好,且新景生物的RNasin对8ng RNase的抑制效果接近Takara生物的RNasin对2ngRNase的抑制效果。
·20-40分钟内即可完成总RNA的分离与纯化·经典酸性酚萃取法与柱纯化法的完美结合·无需氯仿,配置的Buffer EX可完美替代氯仿·样本:动物组织、细胞、植物组织、血液等·应用:RT-PCR、Northern Blot、芯片分析等 查看产品

·快速、准确·兼容性强·操作简便·高效率、高灵敏度及高特异性。 查看产品

不同仪器所需ROX Reference Dye浓度不同 查看产品