最近有客户询问“提取培养细胞RNA用什么试剂盒合适”,新景有几款试剂盒都可以提取培养细胞总RNA,到底推荐哪一款最好呢?于是小新通过实验测试对比了三种RNA提取试剂盒提取培养细胞总RNA的效果差异。
一、 实验目的
通过模拟培养细胞RNA的分离纯化,对比三种提取培养细胞总RNA的试剂盒的提取效率。本次测试中三种RNA提取试剂盒均未进行DNase I柱上消化。
二、 实验材料
过夜培养的枯草杆菌、溶菌酶(Simgen Cat.No.8009100)、1.5 ml离心管(RNase-free)若干
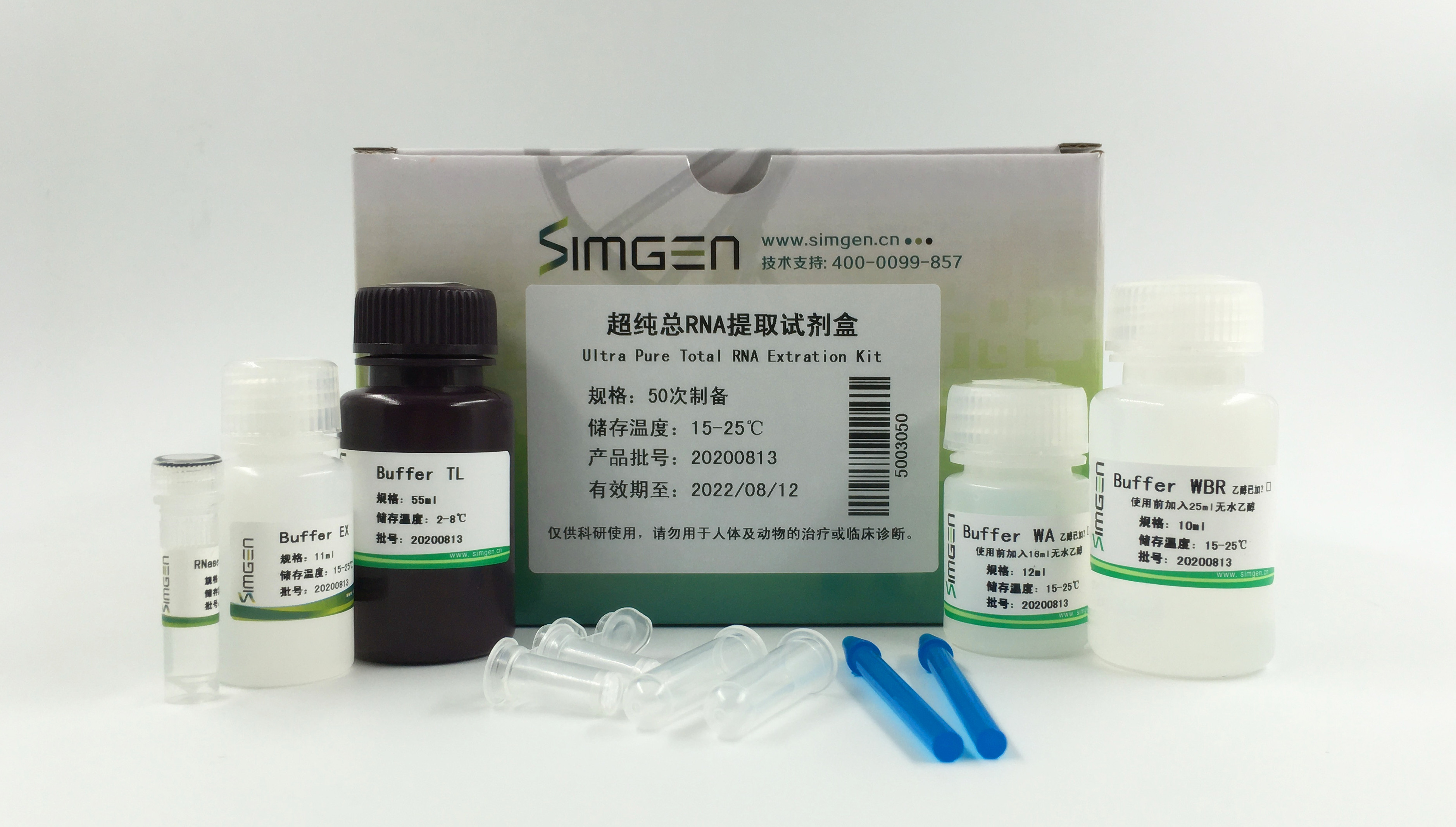
超纯总RNA提取试剂盒(Simgen Cat.No.5003050)
通用型总RNA提取试剂盒(Simgen Cat.No.5010050)
动物组织/培养细胞总RNA试剂盒(Simgen Cat.No.5001050)
台式离心机(eppendorf centrifuge 5415 D)、旋涡振荡器(越新仪器,XH-C)、超微量分光光度计(Simgen Cat.No.sim-100)、电泳仪(北京六一仪器厂,DYY-6C型)
三、 实验方法
按每管2 ml菌液收集过夜培养的枯草杆菌到1.5 ml离心管(RNase-free)中,共5管。每管加100 μl RNase-free Water悬浮细菌沉淀,然后加入100 μl RNase-free Water配制的溶菌酶溶液(16 mg/ml),混合均匀,37℃温育15 min。用移液器将5管液体吹打混合均匀并合成一管,按每管100 μl的量分出9管。按照三种试剂盒的操作方法分别做三组平行提取:
(一)超纯总RNA提取试剂盒
1. 向100 μl处理好的样本中加入1 ml Buffer TL,勿弃吸头,直接用吸头吹打数次使细胞溶解。
2. 加入200 μl Buffer EX,盖上管盖,用力摇晃15秒,12000 rpm离心15分钟。
3. 吸取600 μl上层水相转移到一个洁净的1.5 ml离心管中,加入600 μl Buffer DW,勿弃吸头,直接用吸头吸注两次混匀,进入步骤4的操作。
4. 吸取600 μl混合液转移到核酸纯化柱中,盖上管盖,12000 rpm离心30秒。
5. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,将1.5 ml离心管中剩余的液体全部转移到核酸纯化柱中,盖上管盖,12000 rpm离心30秒。
6. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入500 μl Buffer WA,盖上管盖,12000 rpm离心30秒。
7. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入600 μl Buffer WBR,盖上管盖,12000 rpm离心30秒。
8. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,13200 rpm离心2分钟。
9. 弃2 ml离心管,将核酸纯化柱置于一个RNase-free的1.5 ml离心管中,在纯化柱中加入150 μl RNase-free Water,盖上管盖,室温静置1分钟,12000 rpm离心30秒得到RNA。
(二)通用型总RNA提取试剂盒
1. 向100 μl处理好的样本中加入300 μl Buffer RLA,用移液器吸打混匀,再加入300 μl Buffer RLK,旋涡振荡混匀,室温放置3-5分钟。
2. 12000 rpm离心5分钟,小心吸取上清液转移到一个洁净的1.5 ml离心管中。
3. 加入0.5倍上清体积的无水乙醇,旋涡振荡混匀,使液体成混浊状且有泡沫。
4. 吸取750 μl混合液转移至核酸纯化柱中(核酸纯化柱置于2 ml离心管中),盖上管盖,12000 rpm离心1分钟。
5. 弃滤液,将核酸纯化柱置回到2 ml离心管中,吸取剩余的混合液加入到核酸纯化柱中,盖上管盖,12000 rpm离心1分钟。
6. 弃滤液,将核酸纯化柱置回到2 ml离心管中,加入600 μl Buffer WBR,盖上管盖,12000 rpm离心30秒。
7. 弃滤液,将核酸纯化柱置回到2 ml离心管中,加入300 μl Buffer WBR,盖上管盖,13200 rpm离心2分钟。
8. 弃2 ml离心管,将核酸纯化柱置于一个RNase-free的 1.5 ml离心管中,在纯化柱膜中央加入150 μl RNase-free Water,盖上管盖,室温静置2分钟,12000 rpm离心1分钟得到RNA。
(三)动物组织/培养细胞总RNA试剂盒
1. 向100 μl处理好的样本中加入600 μl已经加入了β-巯基乙醇的Buffer RLT,旋涡振荡直至细胞全部溶解,溶液呈透明状。
2. 将细胞溶解物全部转移到过滤柱中,盖上管盖,13000 rpm离心2分钟。
3. 弃过滤柱,向滤液中加入600 μl 70%乙醇并用吸头吸注6~8次混合均匀,吸取600 μl混合液加入到核酸纯化柱中,盖上管盖,13000 rpm离心1分钟。
4. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,吸取剩余的混合液加入到核酸纯化柱中,13000 rpm离心1分钟。
5. 弃2 ml离心管中的滤液,在核酸纯化柱中加入500 μl Buffer WA,盖上管盖,13000 rpm离心1分钟。
6. 弃2 ml离心管中的滤液,在核酸纯化柱中加入600 μl Buffer WBR,盖上管盖,13000 rpm离心1分钟。
7. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,13200 rpm离心2分钟。
8. 弃2 ml离心管,将核酸纯化柱置于一个RNase-free的1.5 ml离心管中,在纯化柱的膜中央加入150 μl RNase-free Water,盖上管盖,室温静置1分钟,12000 rpm离心30秒得到RNA。
四、 实验结果
1. 在超微量分光光度计上用RNase-free Water调零,测量洗脱下来的RNA,结果如下:

2. 在1%的琼脂糖凝胶上加入5 μl洗脱的RNA(每种提取试剂盒取两管平行)进行电泳,结果如下:

3. 三种RNA试剂盒操作时间及价格差异

五、 分析与讨论
1. 对比不同试剂盒提取到的RNA浓度可知,动物组织/培养细胞总RNA试剂盒提取的细菌RNA浓度最高,远高于超纯总RNA提取试剂盒和通用型总RNA提取试剂盒提取的细菌RNA;通用型总RNA提取试剂盒提取的细菌RNA浓度也略高于超纯总RNA提取试剂盒。
2. 通过电泳图分析可知,动物组织/培养细胞总RNA试剂盒提取的细菌RNA主条带最亮,基因组DNA最少,RNA的小片段也最少。通用型总RNA提取试剂盒提取的细菌RNA中基因组DNA含量最多。超微量分光光度计测得的浓度和电泳的RNA亮度有对应关系。
3. 从RNA提取的原理上分析,不同试剂盒提取的RNA浓度上有差异也是有各自的原因的:
1) 超纯总RNA提取试剂盒采用的是酸性酚萃取RNA的原理,本质上与Trizol试剂提取RNA相同。Trizol试剂在萃取RNA的过程中,在沉淀去除大部分基因组DNA的同时,RNA也会跟着丢失掉一部分,所以超纯总RNA提取试剂盒提取到的RNA是最少的,当然残留的基因组DNA也不是最多的。
2) 通用型总RNA提取试剂盒和动物组织/培养细胞总RNA试剂盒均没有萃取步骤,为什么通用型总RNA提取试剂盒提取的RNA浓度更低一些呢?实际上真正的原因是通用型总RNA提取试剂盒在溶解细菌细胞后DNA和RNA共同吸附到了纯化柱上,大片段基因组DNA与RNA的互相缠绕导致了RNA洗脱困难。如果完全按照通用型总RNA提取试剂盒的操作步骤(试剂盒配套有DNase I供柱上消化使用)操作,不仅可以提高RNA的洗脱效率,还能完全去除掉基因组DNA。
3) 对于动物组织/培养细胞总RNA试剂盒,在做RNA柱纯化之前,先用过滤柱去除了大部分的基因组DNA(从电泳图上可以看出,在细菌细胞没有过量的前提下,基因组DNA去除还是挺干净的),获得的滤液主要都是RNA,所以RNA的洗脱效率高,最终得到的RNA浓度最高,并且DNA的残留也最少。
六、 结论
细菌经溶菌酶破壁处理后的结构与培养细胞非常类似,因此本次测试还是有参考价值的。综上所述,在细胞数量较少的情况下(参考试剂盒说明书中的细胞用量下限),强烈推荐使用Simgen动物组织/培养细胞总RNA试剂盒(Simgen Cat.No.5001050),不仅操作步骤简单,RNA的回收量也最高,并且去除DNA也快速高效。细胞数量中等(参考试剂盒说明书中的细胞用量上限)的情况下,推荐使用通用型总RNA提取试剂盒(Simgen Cat.No.5010050),性价比很高,虽然步骤复杂一点,但是DNA去除比较干净。如果细胞数量很多,并且无法精确估算样本中细胞数量的前提下,推荐使用超纯总RNA提取试剂盒(Simgen Cat.No.5003050),虽然然RNA得率低一点,但是酸性酚萃取RNA的方法能有效地同步去除变性的蛋白杂质和基因组DNA,避免出现纯化柱堵塞等问题。

溶菌酶,也称为胞壁质酶或N-乙酰胞壁质聚糖水解酶,是一种破坏细菌细胞壁的酶,可提高蛋白或核酸抽提效率 查看产品
·20-40分钟内即可完成总RNA的分离与纯化·经典酸性酚萃取法与柱纯化法的完美结合·无需氯仿,配置的Buffer EX可完美替代氯仿·样本:动物组织、细胞、植物组织、血液等·应用:RT-PCR、Northern Blot、芯片分析等 查看产品

·样品用量少,无需稀释,无需比色皿·紫外-可见光全波长扫描(200~850nm)·无需预热,随开随检,速度快,直接显示浓度值·样品的浓度范围是常规紫外-可见分光光度计的50倍·数据统计软件简单容易掌握 查看产品

·20-40分钟内即可完成组织总RNA的分离与纯化。·过滤柱技术快速去除组织溶解物中的杂质。·无需酚氯仿抽提和异丙醇沉淀步骤。 查看产品

·适用样本:动物组织、植物组织、细胞、细菌等·20-40分钟内即可完成RNA的分离与纯化·柱上消化技术快速去除基因组DNA·无需酚氯仿抽提和异丙醇沉淀步骤 查看产品