上期我们用Carrier RNA代替病毒测试了病毒样本保存液和RNA样本保存液对唾液中病毒RNA的保存效果,发现两者差别不大,对唾液中的Carrier RNA均有较好的保护作用。但是Carrier RNA和病毒毕竟还是有差别的,不能按Carrier RNA的测试结果直接推导出病毒样本测试的结果。下面就让我们用新冠假病毒(新冠假病毒:将新型冠状病毒(2019-nCoV,参考序列为NC_045512)的E基因序列合成并克隆构建至慢病毒载体,在293T细胞内进行假病毒的制备。所获得的假病毒为慢病毒基因组中包含E基因228 base的RNA序列。可以用于病毒RNA提取实验和qPCR检测实验的对照品)来测试一下两种保存液的效果吧。
一、实验目的:
对比病毒样本保存液和RNA样本保存液对唾液样本中病毒RNA的保存效果差异。
二、实验材料:
1. 病毒样本保存液(Simgen Cat.No.4112100)
2. RNA样本保存液(Simgen Cat.No.4007020)
3. 新冠假病毒(108 copies/ml)
4. 新鲜采集的人唾液
5. Carrier RNA(Simgen Cat.No.4003101)
6. 2×One Step Probe RT-PCR Mix(Simgen Cat.No.7406100)
7. 新冠病毒特异性引物及探针(F:CCCTGTGGGTTTTACACTTAA/R:ACGATTGTGCATCAGCTGA,Probe:5’-FAM-CCGTCTGCGGTATGTGGAAAGGTTATGG-BHQ1-3’)
8. 电热恒温培养箱(上海精宏实验设备有限公司,DNP-9082)
9. 旋涡震荡器(越新仪器,XH-C)
10. 台式离心机(eppendorf Centrifuge 5415 D)
11. 荧光PCR仪(ABI 7500)
三、实验内容:
用唾液将假病毒稀释至106 copies/ml,按比例与不同保存液进行混合,然后分成两份,一份放入37℃恒温箱中,另一份放入﹣20℃冰箱中,每隔一周提取一次RNA(每种实验条件重复一管),并进行RT-PCR反应,观察保存液的保存效果。
RNA样本保存液:唾液=3:1 | 病毒样本保存液 :唾液=2:1 |
1. 将混合液上下翻转混合均匀,吸取100 μl混合液到RNase-free的1.5 ml离心管中,加入300 μl裂解液和1 μl Carrier RNA,旋涡振荡数秒混合均匀,室温静置10分钟; 2. 加入320 μl无水乙醇,温和地翻转离心管3~5次混合均匀; 3. 稍离,吸取液体到核酸纯化柱中,13000 rpm离心30秒,弃滤液; 4. 在核酸纯化柱中加入600 μl Buffer WA,离心弃滤液; 5. 在核酸纯化柱中加入700 μl Buffer WBR,离心弃滤液; 6. 14000 rpm离心1分钟去除残留液体; 7. 将核酸纯化柱置于一个RNase-free的1.5 ml离心管中,加入50 μl RNase Free Water,室温静置1分钟,离心洗脱得到RNA。 | 1. 将混合液上下翻转混合均匀,吸取300 μl混合液到RNase-free的1.5 ml离心管中,13000 rpm离心2 min; 2. 吸取上清到新的1.5 ml离心管中,加入300 μl 70%乙醇和1 μl Carrier RNA,温和地翻转离心管3~5次混合均匀; 3. 稍离,吸取液体到核酸纯化柱中,13000 rpm离心30秒,弃滤液; 4. 在核酸纯化柱中加入600 μl Buffer WA,离心弃滤液; 5. 在核酸纯化柱中加入700 μl Buffer WBR,离心弃滤液; 6. 14000 rpm离心1分钟去除残留液体; 7. 将核酸纯化柱置于一个RNase-free的1.5 ml离心管中,加入50 μl RNase Free Water,室温静置1分钟,离心洗脱得到RNA。 |
8. 用2×One Step Probe RT-PCR Mix、新冠病毒特异性引物及探针配置好反应液,加入5 μl提取的RNA进行RT-PCR反应。 | |
四、实验结果:
RT-PCR扩增曲线如下:
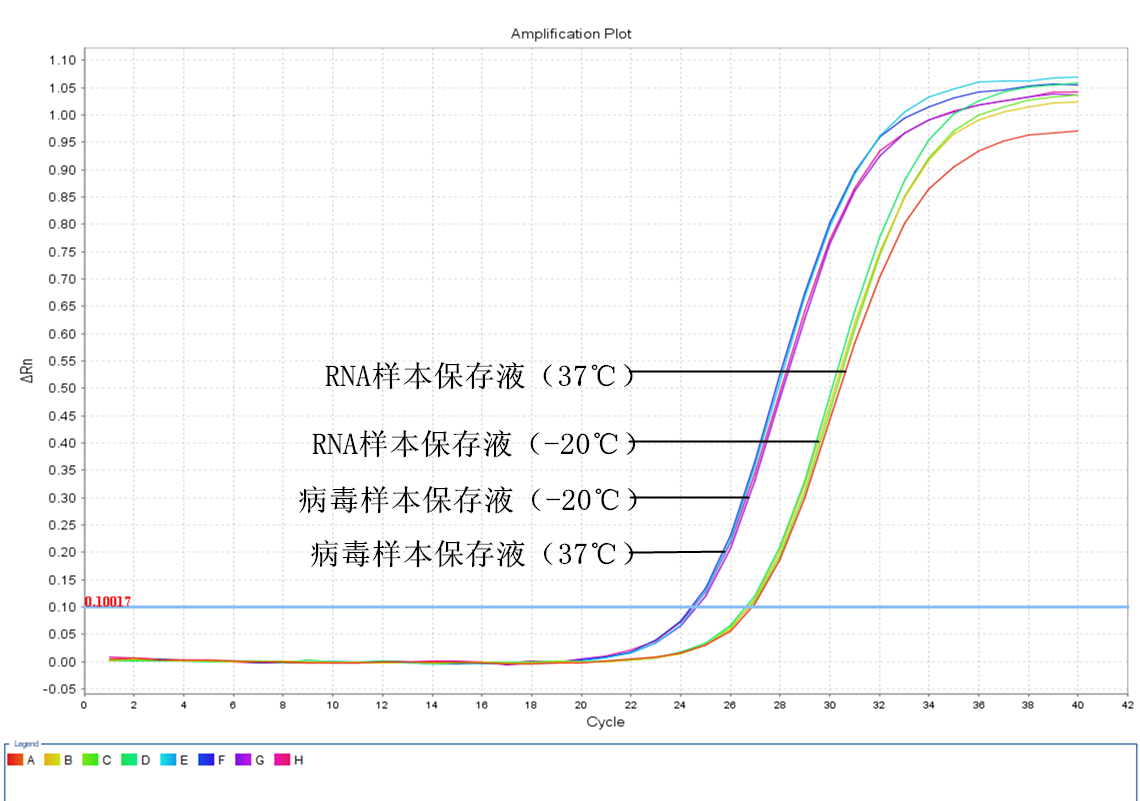
实验当天
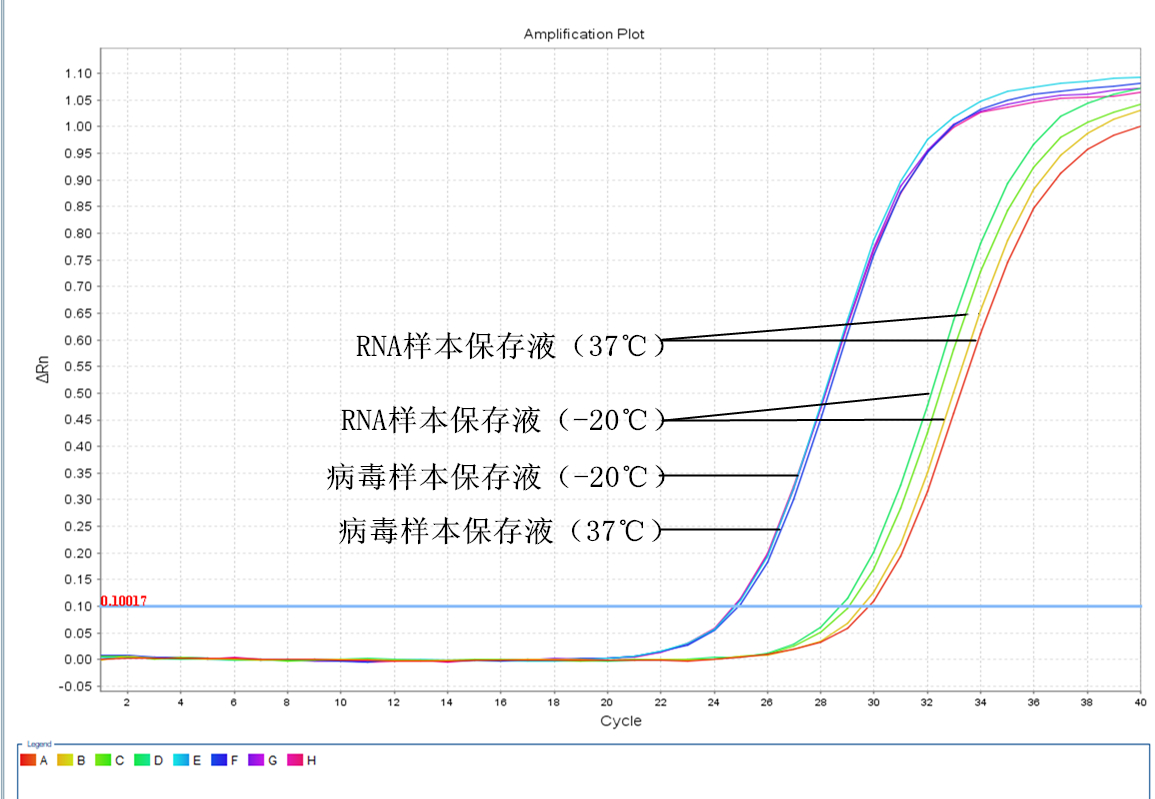
一周后
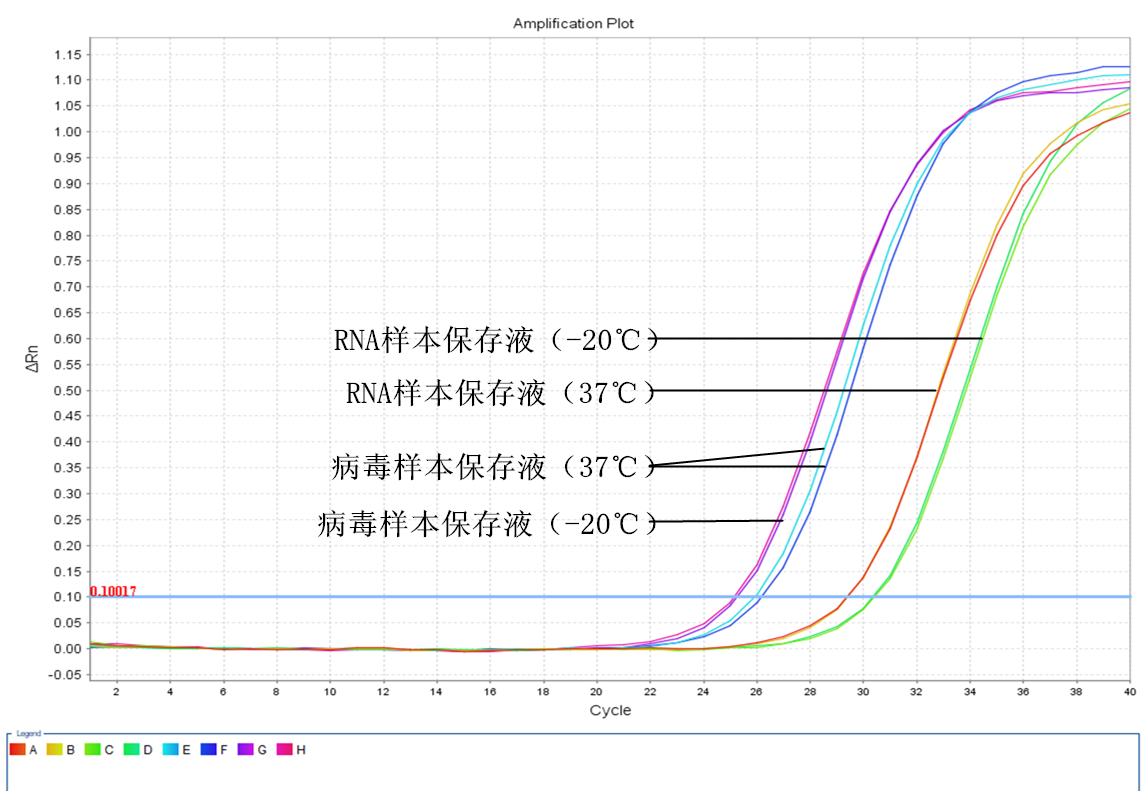
两周后
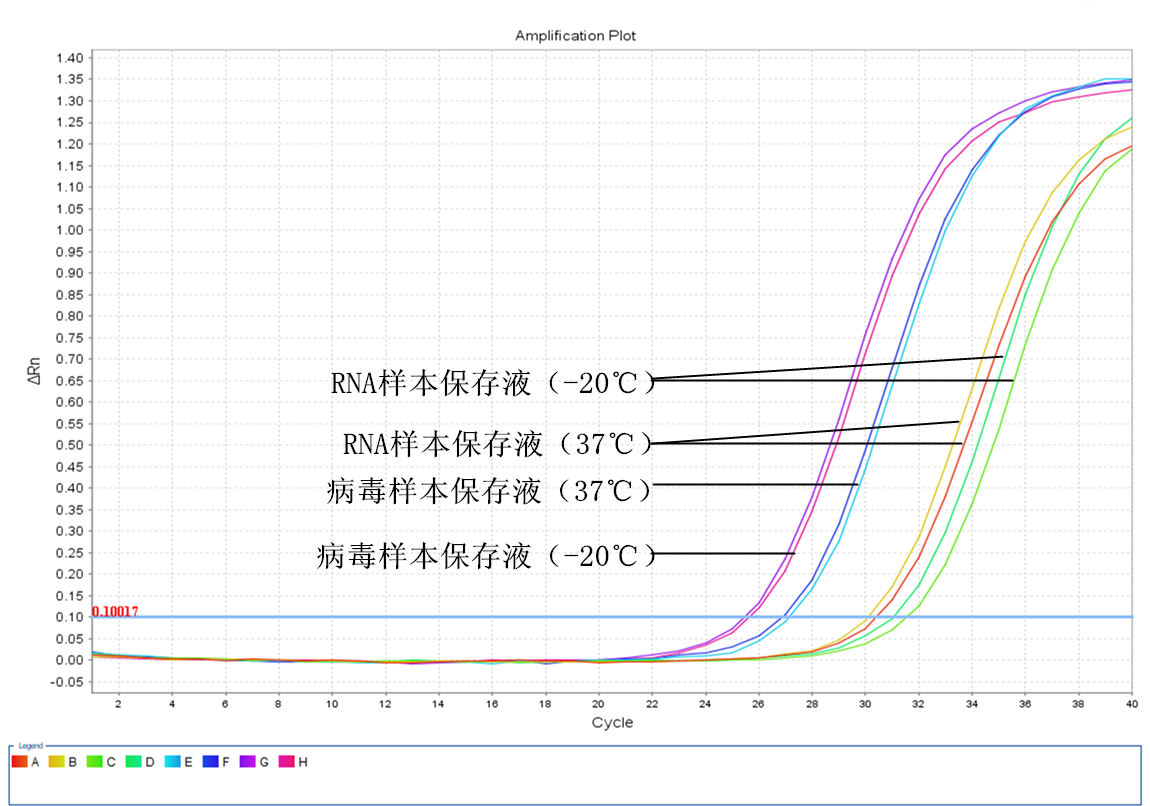
三周后
CT值如下:

一、 实验当天结果分析:讨论与分析:
由于病毒样本保存液起始唾液样本的用量相当于RNA样本保存液的4倍,因此提取到的RNA量也相差4倍,这4倍的浓度差相当于2个CT值。而对比实验当天提取的RNA RT-PCR反应后的CT值,可以发现RNA样本保存液保存的样本的CT值的确比病毒样本保存液的要大2.2左右,与我们预想的结果相符。
二、 第一周实验结果分析:
1. RNA样本保存液保存的唾液样本在不同温度下保存一周后,提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较增大了约2.1~2.9个CT值,且37℃和﹣20℃保存的样本结果差异不明显。可以推理出样本中病毒的RNA降解了约75%以上。
2. 病毒保存液保存的唾液样本在不同温度下保存一周后,提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较增大了约0.3个CT值,同样的37℃和﹣20℃保存的样本结果差异不明显。即使两个完全相同的荧光PCR反应体系,在不同孔间反应产生的CT值也会有差异,因此我们推断病毒保存液保存的病毒RNA降解得很少,或者降解的程度不严重,未影响后续的荧光PCR检测。
三、 第二周实验结果分析:
1. RNA样本保存液保存的唾液样本在37℃下保存两周后,提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较仍然是增大了约2.6个CT值,但奇怪的是﹣20℃保存的样本提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较却增大了约3.7个CT值。也就是说低温保存的样本中的RNA竟然比37℃保存的RNA降解得更严重,和我们预想中的结果不符。
2. 病毒样本保存液的结果与我们预想的一致,﹣20℃保存的效果要比37℃保存的效果更好,但是提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较还是增大了约0.6个CT值,相当于样本中病毒的RNA已经降解了约33%左右。
四、 第三周实验结果分析:
1. RNA样本保存液保存的唾液样本在37℃下保存三周后,提取的RNA进行RT-PCR反应后的CT值与实验当天的CT值比较增大了约3.4个CT值,相当于样本中病毒的RNA已经降解了约90%左右。同第二周一样,﹣20℃保存的样本中的RNA比37℃保存的RNA降解得更严重。
2. 病毒样本保存液保存的唾液样本在37℃下保存三周后,实验获得的CT值与实验当天的CT值比较增大了大约2.5个CT值,相当于80%的病毒RNA已经被降解了,﹣20℃保存的效果第三周和第二周的CT值差别不明显。
经过上述三周的实验结果我们得出以下结论:
1. 确实不能按Carrier RNA的测试结果直接推导出病毒样本测试的结果,病毒RNA似乎比Carrier RNA更容易降解。虽然上次用Carrier RNA测试时推测两种保存液保存唾液中RNA病毒样本的效果差不多,但是通过本次实验测试,却明确地显示出病毒样本保存液保存唾液中RNA病毒样本的效果优于RNA样本保存液。
2. 用病毒样本保存液保存唾液病毒RNA样本,在一周内无论是存放在37℃或者﹣20℃均不影响后续病毒核酸检测。随着时间的延长,﹣20℃存放的RNA样本显示出更好的稳定性。所以我们用病毒样本保存液收集了唾液样本后最好能在一周内提取病毒RNA用于检测,如果条件允许,尽量将样本贮存在﹣20℃。
3. 虽然病毒样本保存液的保存效果更好,但是由于病毒样本保存液会将病毒颗粒溶解,病毒RNA肯定会处于一个缓慢的降解过程中,否则第二周和第三周测的CT值也不会增大了。那为什么第一周内在CT值上的差异并不明显呢?我们猜测是一周内的病毒RNA的降解程度尚未影响到病毒RNA作为PCR扩增有效模板的缘故。以本次实验用的假病毒为例,其RNA长度约为6200 nt,而我们的扩增片段长度仅为119 nt。如果降解后的片段主要是集中在2000-3000 nt,则仍然是远远大于扩增片段长度的,就不会对扩增结果有明显的影响。感兴趣的读者可以看一下之前发的文章——《模板DNA完整性对PCR结果的影响》,里面有详细的讲解。

·常温保存1周,37℃保存1天,4℃至少保存1个月,组织4℃浸泡过夜后-20℃或-80℃可长期保存。·反复冻融:冻存于-20℃或-80℃的组织可反复冻融20次而不影响RNA提取的质量。 查看产品
在柱纯化及磁珠法核酸纯化体系中添加Carrier RNA,可提高10倍以上微量核酸的回收效率。 查看产品

·拥有第一类医疗器械生产凭证备案凭证,质量得到保证;·灭活病毒,保障使用过程的安全性;·获得核酸质量好,得率高,并可立即用于下游实验;·病毒 DNA/RNA 可在常温(0-30℃)保存与运输 1 周不降解。 查看产品

2×One Step Probe RT-PCR Mix是专用于探针法实时荧光定量PCR的两倍浓度的预混合液 查看产品