分子生物学实验中,质粒提取是最常见的也是非常重要的一项实验,是后续实验的基础。同学们在质粒提取过程中最烦恼的问题大概就是质粒提取的浓度低,Simgen实验室有着20几年质粒DNA提取的经验,现在结合各个案例作一个分析总结,供大家做参考。
一、客观因素:
1) 建议认准市场上续存了10年以上的质粒试剂盒生产厂家,不要购买近几年新推出试剂盒的品牌。
出乎很多人的意料,一个质量稳定的质粒DNA提取试剂盒取决于试剂盒中配套的纯化柱,而不是试剂本身。柱子稳定性的问题,做核酸提取试剂盒的厂家几乎都翻过船(国际大牌QI**EN,曾经的杭州维特洁生化、Ta**ra、OM**A等等)。最后成熟的产品采用了两条路线,一条是我们Simgen公司一直坚持的路线,把柱子的稳定性做好,把困难和麻烦留给自己。另一条则是摆烂路线,就是Tia**en,Aid**b等公司的质粒试剂盒,为了解决柱子稳定性的问题,额外增加了用平衡液处理柱子的一个操作步骤----把麻烦留给用户。当然这还算好的,至少质粒DNA还能提取到,最糟糕的就是一些新推出质粒提取试剂盒的公司,试剂盒刚开始用的时候提取质粒DNA的浓度还不错,几个月后,质粒DNA就几乎提取不到,或者提取到的浓度极低了。所以购买质粒提取试剂盒的时候,建议购买品牌已经成立10年以上的公司的产品。
2) 质粒拷贝数低
虽然写了这个因素,但总体来看,这个因素还是比较少的,除了像BAC,PAC之类的大质粒之外。有一个因素需要提示一下:同样是一个pUC-19的质粒,空载体pUC-19接近于3K的长度,重组pUC-19质粒如果是插入了一个3K的基因,那么在其他条件相同的情况下,提取到重组的pUC-19质粒DNA的浓度会比空载体pUC-19质粒DNA浓度高一倍左右。具体原因请大家自行脑补。
二、主观因素:
1) 细菌的接种(最容易犯的通病)
首先提两个问题:一、我们培养细菌的时候加入的抗生素是否会直接杀死不带质粒的大肠杆菌?二、我们做质粒转化后的平板中的单克隆菌落中,是否只含有一种携带质粒的大肠杆菌?
如果你觉得上面两个问题的答案都是肯定的,那问题就比较大了,因为有了上述两项错误的认知,它会直接指导同学们在细菌接种中跟进各种错误的操作。
问题一的答案:抗生素通常是阻止了细菌正常的生理活动,导致的结果是不能繁殖,而非直接杀死细菌。以最常用的氨苄青霉素为例,其机理是阻碍细菌细胞壁的合成,阻碍细胞壁合成的结果,并不等于直接杀死。大家可以回顾一下微生物学中的内容,是不是有一种L型细菌,没有细胞壁也能活得好好的。
第二个问题的答案和问题一的答案紧密相关:虽然平板中的单菌落是携带质粒DNA的大肠杆菌繁殖出来的,但是根据问题一的答案,你还认为单菌落之外的培养基上就没有活的细菌了吗?大家脑补一下微观世界中的场景:这些没携带质粒的细菌都在等待机会,等待抗生素失效后重新繁殖。等不到怎么办呢?找个大腿抱一下,跟着携带质粒的细菌一起繁殖呗,所以答案二是单克隆菌落中是混有不携带质粒的大肠杆菌的。
有同学会问:有证据吗?那请看图片(估计很多同学也观察到过类似的现象):
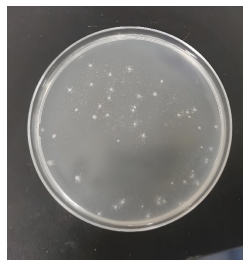
这是一个转化实验后涂的平板在2-8℃冰箱中放置几天后发生的变化:原来没有转化子的位置出现了很多细小的菌落,就是因为抗生素在缓慢地失效,一些等到机会的细菌便开始繁殖了。当然这些细小的菌落围绕着大菌落的会更密集,为什么呢?这是因为大菌落中的细菌在分泌分解抗生素的酶,大菌落周围的抗生素都被分解了,小菌落借着大菌落提供的抗性资源在生长繁殖。
了解上述背景知识后,我们来解释一种同学们最容易犯的细菌接种问题:引用Simgen质粒提取试剂盒的说明书内容要求:从新鲜培养的平板中挑取一个单克隆菌落,接种到3-5 ml含对应抗生素的LB培养基中,37℃,剧烈振荡培养12-16小时。
有些想偷懒的同学就会想,每次接种细菌都要重新在平板上划线多麻烦,干脆留一点培养物做种子多简单?在这里,小新必须点名批评医学院和药学院的同学,为什么他们最喜欢这么干?因为他们经常会培养细胞,培养细胞的时候,留一些养好的细胞接种那可是标准的操作步骤哦。而培养细菌时这么操作的后果就是提取到的质粒DNA浓度越来越低。
具体原因解释如下:因为初代转化出来的单克隆菌落中混有不带质粒的大肠杆菌,假如第一代细菌培养物中只含有10%不含质粒的大肠杆菌,取这个菌液再次接种后,不含质粒的大肠杆菌很可能会提高到20%。为什么呢?因为含质粒的大肠杆菌需要额外复制质粒DNA,并且还要表达生产分解抗生素的酶,工作辛苦长得慢,不带质粒的大肠杆菌靠享用了有质粒的细菌生产的酶带来的好处,摸鱼混日子自然长得快了。当然也不排除有些含质粒的细菌发现丢掉质粒也能生长得挺好(其实是因为别的含质粒的细菌在分解抗生素的原因),身体里怀着质粒宝宝就是个累赘,在繁殖的过程中干脆把质粒丢弃了,变回了不含质粒的普通大肠杆菌。所以,只要你连续用菌液接种几代,虽然细菌看上去正常生长,但是培养物中含质粒的细菌其实会越来越少,导致提取到的质粒DNA浓度越来越低。
这些同学在反馈问题时通常还都会加上一句:你们的产品一开始用提取到的DNA浓度挺高的,然后浓度越来越低,你们的产品好像很快就失效了…….
我们有个投诉的用户寄过来一些培养好的菌液,直接提取发现质粒DNA浓度确实很低,但是当我们把提取到的质粒DNA重新转化了一下,然后挑单菌落提取质粒DNA,浓度提升了10倍以上! 所以,如果你开始怀疑你保留的菌种中质粒DNA可能有丢失的情况,最简单的方法就是把质粒DNA重新转化一次,问题可能很快就解决了。
2) 注意无菌操作
初次做分子生物学实验的同学通常是谨慎小心的,但到了后期就开始大大咧咧了,因为酶切、PCR之类的都不需要无菌操作。然后呢接种细菌也开始无所谓了……我们碰到过浙江大学的一个实验室的投诉,他们说用我们的试剂盒提取质粒DNA浓度变低了,还特别提到可能是Buffer II有问题,因为溶菌后溶液不够透明。由于同一个批次的产品没有用户投诉,我们就派了技术支持上门,结果带回来个惊天大瓜:他们实验室统一的认知是不需要在超净台接种细菌,理由是培养基里已经添加了抗生素了……what?! 估计他们忘了一点,最常用的氨苄青霉素和卡那霉素只对细菌有效,对真菌是无效的啊 !
总结一下:Buffer II只能溶解革兰氏阴性菌(革兰氏阳性菌也不能溶解),如果发现用Buffer II裂解细菌时不够透明,比较浑浊,就要怀疑培养的细菌中已经混有真菌了;如果加入Buffer II裂解细菌时不仅浑浊,甚至没有粘稠感,那更糟糕,证明培养物中根本没有大肠杆菌,或许挑取接种的是平板上一个真菌的菌落。
3) 从过多的细菌中提取质粒DNA
在一定范围内,提高细菌用量是能提高质粒DNA回收量的。但是如果使用了过量的细菌,会导致质粒DNA释放得不够充分,最后质粒DNA的回收量反而下降。(感兴趣的同学可以看一下之前的文章“质粒DNA提取时加大菌液用量会有什么影响?”)当然,不同的菌种,不同的培养基条件下细菌生长的密度都是不同的,那么我们怎么粗略地判断是否使用了过量的细菌呢?
第一种情况:如果加入裂解液Buffer II裂解细菌时裂解产物非常粘稠,像鼻涕一样粘稠,翻转离心管时都难以流动了,可以判断为使用了过量的细菌。
第二种情况:加入中和液Buffer N8(也包括Buffer III、Buffer N3)后形成的沉淀物难以收缩并分散开来,离心后沉淀不到底部,甚至呈现为膨胀的悬浮状态,也可以判断为使用了过量的细菌。
我相信很多同学加大细菌的用量无非是想多提取一些质粒DNA,其实改变培养基的组分可能是更简便的提高单位体积细菌培养物中质粒DNA含量的方法:将LB培养基中的NaCl含量提高到10 g/L,每毫升LB细菌培养物的质粒DNA得率能提高2 μg左右。
4) 请将提取到的质粒DNA电泳验证
虽然大多数情况下,提取到的质粒DNA用分光光度计测个浓度和纯度就可以进行下一步实验了。但是如果你观察到OD260/ OD280高于1.9的时候,必须要考虑质粒DNA中残留的RNA已经影响到质粒DNA浓度的定量了,所以请务必用电泳验证下质粒DNA的浓度。
我们紧跟问题3)中使用过量细菌提取质粒DNA后可能产生的问题:也许正是因为有同学加大细菌用量后测得的浓度有所提高,就变本加厉持续加大细菌的使用量了。但他们很快就会发现OD260/ OD280都快接近2.0了。这种现象背后真正的原因是菌体释放的RNA已经超出Buffer I中RNase A能消化的上限了,没有被消化的RNA片段太长,就会和质粒DNA一起吸附到纯化柱上,再一起洗脱下来。这时候电泳验证一下,就会发现,虽然测OD260推算出质粒DNA的浓度挺高,但电泳会发现质粒DNA条带并没有变亮甚至变暗了,同时在溴酚蓝附近出现了比较明显的亮斑,这些亮斑就是残留的RNA,它会极大地提高OD260的吸收峰值。
我们看一张电泳图 :
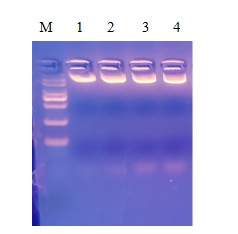
这是有效期内的Buffer I对照加入RNase A的时间已经超过6个月的Buffer I提取5 ml同一菌液中的质粒DNA后的电泳图。(需要备注的是,为了显示出残留的RNA,我们特别上样了8 μl提取的质粒DNA,并减少了电泳时间。如果上样量少,或者电泳时间太长,可能就观察不到这些残留的RNA了。)电泳看上去质粒DNA亮度差不多的质粒DNA,可分光光度计测得的数据完全不同,见下表:
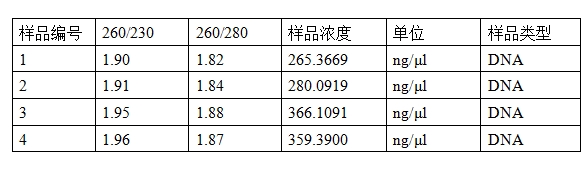
所以,我们可以得出结论:仅仅这些降解的RNA亮斑就贡献了接近100 ng/μl 虚高的质粒DNA浓度。我们可以想象一下,新买的质粒试剂盒刚加入RNase A,提取的质粒DNA中没有RNA残留,而之前使用的老试剂盒,RNase A加入时间过久,提取的质粒DNA中有RNA残留,导致新试剂盒提取的质粒浓度远低于老试剂盒,因此让你有了新买的试剂盒效果不行的错觉,但是实际上两者提取到的质粒DNA是差不多的。
最后我们提示一下在哪些情况下非常有必要用电泳验证质粒DNA的真实浓度:
A. 提取到的质粒DNA OD260/ OD280高于1.9
B. 试剂盒的Buffer I中加入RNase A的时间接近或超过6个月了
C. 冬季环境温度较低,会导致RNase A活性降低;或者在现象上已经可以判断出使用了过量的细菌的情况下
5) Buffer II有沉淀
如果Buffer II中的沉淀物(是SDS)没有溶解就使用,结果会怎样?
我们分别使用有沉淀产生的Buffer Ⅱ、水浴后沉淀消失的Buffer Ⅱ和Buffer NⅡ提取3 ml的同一细菌培养物,提取效果对比如下:
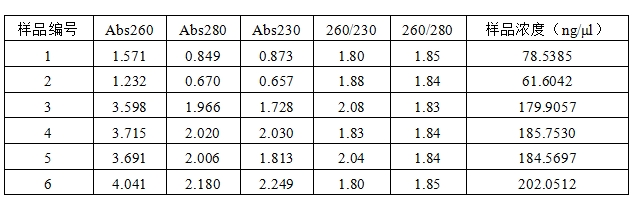
1、2为使用有沉淀产生的Buffer Ⅱ的提取结果;3、4为新配方Buffer NⅡ的提取结果;5、6为水浴后沉淀消失的Buffer Ⅱ的提取结果。
再结合电泳图看一下:
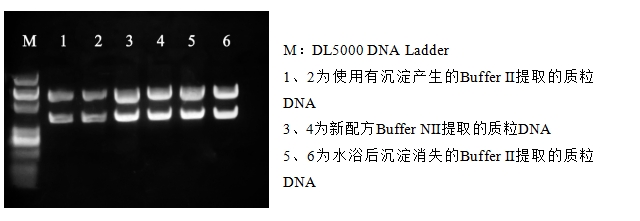
结合分光光度计测量结果和电泳图,可以得知低温情况下Buffer Ⅱ析出白色沉淀时,若一时疏忽没有发现就直接使用,那质粒得率将会大幅度降低。因此温度较低时进行质粒提取实验的同学一定要注意观察Buffer Ⅱ是否出现沉淀。
看到这有同学会问了,那个Buffer NⅡ是什么?这是我们Simgen特意研发推出替代Buffer II的新产品——在0~10℃的低温条件下依旧不会产生沉淀,提取效果与沉淀溶解的Buffer Ⅱ提取质粒效果相当,能完美替代Buffer II,解决各位同学的后顾之忧。目前这款产品还在测试阶段,后续将会逐步更新到各款质粒提取试剂盒中。