最近实验室接到一个客户的投诉,说是购买的DL2000 DNA Ladder有问题,跑电泳时出现DNA降解的情况。由于Simgen的DNA Marker含有DNA稳定剂,曾经在室温条件下做过放置一年的真实稳定性测试,都未观察到DNA降解的现象,所以对于客户的投诉感到非常疑惑。但是为了慎重起见,我们还是从库存产品中抽了一支相同批次的DL2000 DNA Ladder进行了电泳实验,结果显示条带正常,并未出现降解情况。
既然不是产品本身的问题,那么就有可能是电泳过程中出现的问题。Simgen实验室经过探索,最后我们猜测可能已经找到了问题的症结所在,结合之前有一篇详细介绍如何制作一张漂亮的琼脂糖凝胶电泳图的文章,今天再给大家介绍一个非常容易被忽略的因素——核酸染料的用量。
一、实验材料:
DL2000 DNA Ladder(Simgen Cat.No.MD1006)
琼脂糖(BIOWEST REGULAR AGAROSE G-10)
溴化乙锭(EB)(Simgen Cat.No.9026001)
电泳仪(北京六一仪器厂,DYY-6C型 )
二、实验步骤:
1. 取10 ml 50×TAE,加入490 ml去离子水,混合均匀,稀释成1×TAE。
2. 用琼脂糖,1×TAE制作两块相同浓度(1%)的凝胶,一块加入正常用量的溴化乙锭(终浓度0.5 μg/ml),一块加入过量的溴化乙锭(终浓度3 μg/ml)。
3. 分别在两块凝胶中依次加入1.5 μl、5 μl、10 μl DL2000 DNA Ladder,放入同一电泳槽进行电泳。
4. 每隔一段时间取出凝胶,观察并记录条带情况。
三、实验结果:
电泳图如下,图一电泳了10分钟,图二电泳了15分钟,图三电泳了20分钟,图四是电泳25分钟的条带情况,每张图的左侧部分是正常溴化乙锭用量的凝胶,右侧部分是过量溴化乙锭用量的凝胶。

1. 从图一来看,两块凝胶跑出来的条带情况差不多,都很模糊,这是因为电泳时间太短,条带没能完全分开,挤成一团显得很糊,这再次验证了电泳时间的重要性。
2. 图二显示,左侧条带开始有分散开的趋势,而右侧条带除了最上方的那条,其余条带仍旧挤成一团,模糊不清。
3. 从图三、图四可以看出,左侧的DL2000 DNA Ladder条带均已分开,带型清晰,而右侧的DL2000 DNA Ladder下方条带仍旧十分模糊,类似拖尾的状态,和降解情况很是相像。仔细看的话,还能够发现加的DNA量越多,条带越糊。
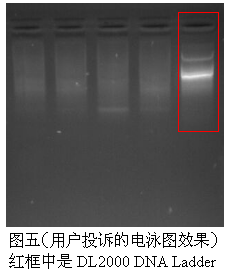
4.仔细对比图一到图五,可以发现,客户投诉说Marker有降解情况的条带(图五)与图一和图二中溴化乙锭过量导致的条带情况很是类似,均是最上面的条带分开了,下面的其他条带挤在一起,模糊不清。
四、讨论与分析
1. 我们通过实验证明了:溴化乙锭用量过多会导致电泳的条带变模糊,出现类似拖尾的情况。
2. 关于溴化乙锭会影响DNA条带的泳动速度,早有前辈们已经提到过了——有一种精确标定DNA分子量的电泳方法是这样要求的:制作一块不含溴化乙锭的琼脂糖凝胶,电泳结束后再将凝胶放入含溴化乙锭(0.5 μg/ml)的电泳缓冲液中浸泡30—45分钟,待溴化乙锭分子嵌入DNA分子后再在紫外灯下观察。(分子克隆实验指南 精编版P.158)
3. 从深层次分析原因,我们猜测可能性如下:核酸是带负电的,而溴化乙锭中能嵌入DNA双链中的基团是带正电的(溴离子不参与染色),电泳过程中两者的运动方向刚好相反,当溴化乙锭量过多的情况下,对核酸的反向作用力就显现出来了:通过给核酸向正极的泳动施加一个阻力,使得核酸的移动变得困难,相同长度的条带的核酸泳动速度变得混乱,最终使整个条带因此变宽了,如果多个条带黏连在一起就形成了类似降解的现象。这种现象随着核酸上样量的增加,会变得越发明显。
因此,溴化乙锭等类似的核酸染料使用过程中一定要控制好用量(注意Gelred或者Gelgreen核酸染料更要注意控制用量,因为Gelred是由两个溴化乙锭分子拼接起来,而Gelgreen则是由两个SYBR Green分子拼接起来的,显色灵敏度或许更高了,但嵌入核酸分子中后的阻力也更大了),按说明书上的标准用量使用,切忌太过随意。

核酸分子琼脂糖凝胶和聚丙烯酰胺凝胶电泳。同时作为电泳缓冲液和凝胶制备缓冲液。 查看产品

添加两种优化的Loading Buffer染料,不遮挡DNA条带荧光亮度条带细致调整,每一个片段都足够清晰 查看产品

高度灵敏的荧光染色剂,用于观察琼脂糖和聚丙烯酰胺凝胶中的DNA,302nm紫外光透射仪激发并放射出橙红色信号。 查看产品