前段时间,小编做感受态细胞检测总是效果不佳,不得已逐一排查影响因素。原来只是想看看质粒DNA是不是有降解的现象,结果出乎意料地发现了一个惊人的结果:质粒DNA不但没降解,反过来似乎连在一起,分子量变大了?!
先描述下实验测试的方法:
一、实验准备:
质粒样本:新鲜抽提的pUC-19以及-20℃冰箱里存放并且多次使用的pUC-19。
实验材料:1%的琼脂糖凝胶、1.5ml离心管、EcoR I内切酶。
实验设备:台式小量离心机、电泳仪、恒温培养箱、微量紫外分光光度计、移液器等。
二、实验内容:
1、取20μl新鲜提取的pUC-19以及冰箱存放的pUC-19,分别配制EcoR I酶切体系置于37℃培养箱中酶切2h;
2、在1%的琼脂糖凝胶上,依次加入质粒DNA或相应质粒DNA的酶切产物,分别在电泳进行15min、30min、45min后在紫外灯下观察结果并拍照。
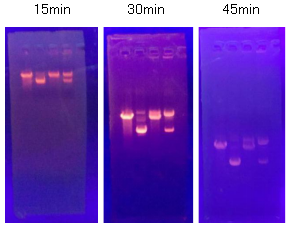

三、实验结果:
为了更清晰地描述,小编特意做了一张模拟图,如下,
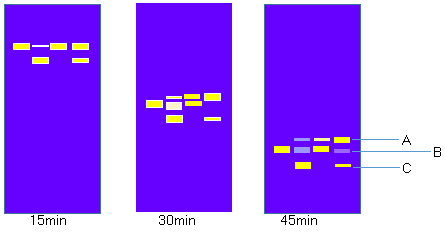
可能很多人都听说经典的质粒DNA三条带的理论:“共价闭合环状DNA(cccDNA): 质粒的两条链没有断裂,超螺旋结构;开环DNA(ocDNA): 质粒的一条链断裂,松弛的环状分子;线形DNA(lDNA): 质粒的两条链均断裂,线性分子”。
按照上述理论,C是超螺旋结构;A是一条链断裂,松弛的环状分子; B是线性分子(B在单酶切的位置)。但是松弛的环状质粒DNA为什么比线性质粒DNA跑得慢呢?既然超螺旋结构因为穿过琼脂糖凝胶的阻力最小,跑得最快,那A(松弛的环状分子)应该跑第二位啊?
再有:位置A一开始总是与B重合的,以至于我们平时总是下意识地将它认作是线性质粒。然而,当电泳时间足够长时,它会与B位置分隔开,并且在新鲜提取的质粒(含量较少)、存放过久的质粒及其酶切产物中都会出现。而且在冰箱冻存过的质粒体系中占有很大的比重(电泳条带宽度及亮度)。这A到底什么鬼?
请教领导,结果领导反对经典的三条带理论,明确地表示:C位置为我们常见的超螺旋结构的质粒,B位置为pUC19酶切后的线性质粒,A是两个超螺旋结构的质粒DNA聚合在一起了,简称质粒二聚体。质粒二聚体理论上是正在复制的过程中的质粒被提取出来了,所以分子量是超螺旋结构的一倍。
听上去还是领导的理论更合理,那问题来了:为什么质粒在冰箱里冻存一段时间后超螺旋结构大量地转变成了二聚体结构呢?。结果领导两手一摊,不知道。最后他说,实际上A是二聚体也只是看上去更合理的一种理论而已,不排除其他的可能性。你可去大胆地去猜测形成二聚体质粒(或者是松弛环状分子)的各种原因,重要的是用实验去验证你的理论。
于是小编开始了天马行空的臆想:
1. 第一个嫌疑是反复冻融--在分子生物学实验中,经常会看到一句话“切忌反复冻融”,会不会是因为冻融过程中形成的冰晶对质粒DNA产生了损伤,才导致质粒DNA电泳的带型产生变化的?如果质粒DNA损伤的理论是正确的,似乎A是松弛环状分子更合理,唯一的矛盾是A酶切不能被完全切开,很难解释。
2. 如果是反复冻融先损伤质粒DNA--比如产生了部分单链DNA,再由于质粒之间有大量共同序列,或许部分单链DNA之间就互补配对上了,结果就生成了A(质粒二聚体)。这样似乎也解释了为什么有一部分A(质粒二聚体)酶切切不开:如果酶切位点刚好包含在二聚体的铰链中(包括在酶切位点附近),估计限制性内切酶就无能为力了。
3. 除了反复冻融,还有什么因素会损伤DNA呢?染菌!质粒DNA并不是在无菌环境下提取的,有微生物在质粒DNA中就难说了,会不会是微生物产生的酶类促使质粒部分解旋成单链并与其它质粒缠绕在一起从而形成二聚体呢?——至少这个猜测比较容易设计实验验证。
4. 或许是DNA溶液中残留的二价阳离子是罪魁祸首……DNA分子不是带负电的吗,二价阳离子左手右手各拉一个质粒DNA,二聚体就产生了……
当然,以上影响因素都是小编的主观猜测,并不能确定是谁是导致质粒结构变化的罪魁祸首,如果您也有类似的发现,并且还用实验测试验证过,欢迎告知我们:technical@simgen.cn
回到转化实验,既然质粒DNA在电泳能呈现那么多不同的带型,那么不同带型的质粒对转化效率有什么影响呢?请继续关注我们下一期的核酸技术探索。