之前有个客户投诉说我们的全血DNA小量试剂盒提取的血液DNA浓度很低,效果不好。小新感觉很奇怪,全血DNA小量试剂盒是我们的明星产品,采用专利技术方法提取的血液DNA,比市场上的血液DNA提取试剂盒操作更加简便,加上样本用量大,提取同一个血样的时候,DNA浓度通常只会更高----于是小新立刻与客户进行了沟通,经过详细询问才发现原来客户之前经常提取质粒DNA,这次提取血液时怕剧烈操作会弄断基因组DNA,因此没有按照说明书写的剧烈操作,而是温和地操作。为了验证是否是这个原因导致提取的DNA浓度低,小新决定实际测试一下。由于Simgen细菌DNA试剂盒同样采用了全血DNA小量试剂盒的专利技术提取基因组DNA,小新决定先用细菌样本测试一下。
实验目的:
测试细菌DNA试剂盒提取过程中剧烈操作与温和操作对实验结果的影响。
实验材料:
过夜培养的DH5α细菌、细菌DNA试剂盒(Simgen Cat. No.3302050)
旋涡震荡器(越新仪器,XH-C)
台式离心机(eppendorf Centrifuge 5415 D)
超微量分光光度计(Simgen Cat.No.sim100)
电泳仪(北京六一仪器厂,DYY-6C型 )
实验内容:
剧烈操作 | 温和操作 |
1. 用1.5 ml离心管收集3 ml细菌培养物,加入200 μl Buffer TE,旋涡震荡充分悬浮细菌。 2. 加入100 μl溶菌酶溶液,旋涡震荡约15秒混匀,37℃水浴30分钟。 3. 加入225 μl Buffer L1,旋涡震荡30秒。 | |
4. 加入225 μl Buffer L2,剧烈摇晃离心管3~5次,再旋涡震荡30秒混匀。 | 4. 加入225 μl Buffer L2,温和的上下颠倒混匀30秒。 |
5. 13000 rpm离心2分钟。 6. 将步骤5中的上清液倒入到核酸纯化柱中(核酸纯化柱置于2 ml离心管中),盖上管盖,12000 rpm离心30秒。 7. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入500 μl Buffer WA, 盖上管盖,12000 rpm离心30秒。 8. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入600 μl Buffer WB, 盖上管盖,12000 rpm离心30秒。 9. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,14000 rpm离心1分钟。 10. 弃2 ml离心管,将核酸纯化柱置于一个洁净的1.5 ml离心管中,在纯化柱中央加100 μl 37℃温育的Buffer TE,盖上管盖,室温静置1分钟,12000 rpm离心30秒。 11. 洗脱下来的DNA测量浓度并进行电泳检测。 | |
实验结果:
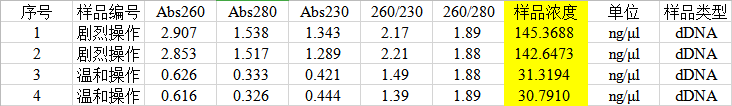
1. 在超微量分光光度计上用Buffer TE调零,测量提取的DNA,结果如下:
2. 在1%的琼脂糖凝胶上,加入5 μl提取到的DNA,电泳30 min,结果如下:
实验讨析: 
1. 从超微量分光光度计测量的结果上可以看出,剧烈操作提取的DNA浓度是温和操作提取的4倍以上,Abs260/280几乎没有差别,而Abs260/230值剧烈操作提取的DNA更好 。
2. 从电泳图上可以看到,两种操作方法提取的DNA电泳的位置差不多,剧烈操作提取的DNA的亮度要明显亮于温和操作提取的DNA,与分光光度计测得的数据有较好的对应关系。
大肠杆菌的基因组DNA长度是4.7×106bp,也就是说有接近5000kb的长度,这么长的DNA是非常容易断裂的(仅仅是用移液器吸取一下DNA溶液就会对DNA有一个剪切的作用),更不用说比细菌基因组DNA更长的人类基因组DNA了。这种断裂在整个提取过程中都是无法避免的,这就是为什么我们提取到的基因组DNA片段一般都集中在30-50kb的缘故。
Simgen细菌DNA试剂盒没有使用蛋白酶K消化蛋白,所以更需要剧烈的操作步骤使DNA和蛋白质分离开,否则基因组DNA就伴随着沉淀物丢失了。我们从电泳图中也可以发现,温和操作获得的基因组DNA长度没有比剧烈操作获得的基因组DNA更长;剧烈操作获得的基因组DNA也没有非常严重的拖尾现象。因此建议大家在提取DNA的过程中一定要按照试剂盒说明书上的要求操作,如果遇到怀疑或不理解的操作步骤可以先和技术支持沟通一下,千万不要想当然地去更改操作方法,否则结果可能是适得其反。
·15分钟内即可完成血液总DNA的制备·无须事先分离去除红细胞及蛋白酶K消化步骤,可室温运输储存·彻底清除血样中的PCR抑制物,可使用多至1/2反应体系体积的模板进行扩增 查看产品

·专利技术应用,更显新颖快捷· 无需蛋白酶K和RNA酶消化步骤·特殊设计的蛋白沉淀步骤,确保从过量的细菌中纯化DNA时,纯化柱也不被堵塞 查看产品