科学家们评估外星球是否可能存在生命时第一个考虑的因素就是水,进一步的,再考虑是否存在液态水。毕竟,地球上降水丰富的热带雨林生命丰富多彩,缺水的沙漠可就难觅生命的迹象了。最近实验室在提取土壤DNA时发现提取到的DNA浓度时高时低,怀疑是土壤样本的差异造成的。土壤都是在实验室附近的池塘边采集的,虽然不是同一位置,但都是池塘边的土壤,会有这么大的差异吗?为了一探究竟,小新在池塘边同一方向的位置采集了三份土壤样本,分别是池塘边的土壤、距离池塘边0.5 m位置的土壤、距离池塘边1 m位置的土壤,然后同时用Simgen土壤DNA纯化试剂盒提取土壤DNA,让我们一起来看看结果如何。
一、 实验目的
测试同一区域不同含水量土壤DNA提取的浓度差异。
二、 实验材料
1. 新鲜挖掘的土壤(临近池塘、距离池塘0.5 m、距离池塘1 m)、1.5 ml离心管和2 ml离心管若干
2. 土壤DNA纯化试剂盒(Simgen Cat.No.4102050)、DL15000 Ladder(Simgen Cat.No.MD1007)
3. 台式离心机(eppendorf centrifuge 5415 D)、旋涡振荡器(越新仪器,XH-C)、水浴锅(上海宜昌仪器纱筛厂)、超微量分光光度计(Simgen Cat.No.sim-100)、电泳仪(北京六一仪器厂,DYY-6C型)
三、 实验方法
1. 称取500 mg土壤,加入到2 ml样品管中。加入1 ml Buffer PD,旋紧管盖,在旋涡振荡器上剧烈旋涡振荡10分钟。
2. 加入20 μl蛋白酶K贮存液,盖上管盖混匀,70°C水浴15分钟。水浴期间每隔5分钟剧烈旋涡振荡30秒。
3. 加入200 μl Buffer ST, 剧烈旋涡振荡30秒混匀,13000 rpm离心10分钟。
4. 吸取上清(约1 ml左右)转移到另一个洁净的有盖2 ml离心管中。
5. 加入800 μl异丙醇,温和地翻转4~6次混和均匀。13000 rpm离心10分钟。
6. 弃上清,3000 rpm离心5-10秒使残留的上清液聚集到离心管底部。用移液器吸尽残留的上清液,保留管底沉淀。
7. 加入100 μl 70℃温育的Buffer TE,旋涡振荡直至沉淀全部溶解。
8. 加入500 μl Buffer P,温和地翻转4~6次混和均匀。吸取混合液加入到核酸纯化柱中,盖上管盖,12000 rpm离心30秒。
9. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入600 μl Buffer WB,盖上管盖,12000 rpm离心30秒。
10. 弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,13200 rpm离心2分钟。
11. 弃2 ml离心管,将核酸纯化柱置于一个洁净的1.5 ml离心管中,在纯化柱的膜中央加入100 μl 70℃温育的Buffer TE,盖上管盖,室温静置1分钟,12000 rpm离心30秒得到DNA。
四、 实验结果
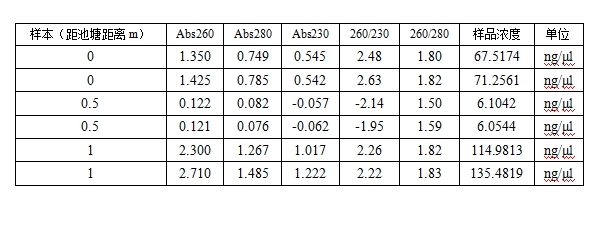
1. 在超微量分光光度计上用Buffer TE调零,测量洗脱下来的DNA,结果如下:
2. 在1%的琼脂糖凝胶上加入5 μl洗脱的DNA进行电泳,结果如下:
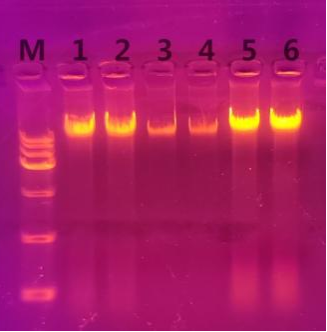
M:Simgen DL15000 Ladder
1、2:靠近池塘的土壤提取的DNA
3、4:距离池塘0.5 m的土壤提取的DNA
5、6:距离池塘1 m的土壤提取的DNA
五、 分析与讨论
1. 由浓度测量结果及电泳图可知,距离池塘1 m处的土壤提到的DNA浓度最高,其次是靠近池塘处的土壤,而在中间位置也就是距离池塘0.5 m处的土壤提到的DNA浓度最低。由此可见,即使相邻很近的土壤,其提取的DNA也会存在很大差异,这也能解释实验室之前提取土壤DNA时为什么浓度时高时低了。
2. 没有进行实验测试前我们想当然地认为靠近池塘边的土壤水含量高,微生物含量高,相应的DNA含量自然也高。然而经过本次实验测试说明土壤中的微生物的生长状况肯定不是只由土壤中水的含量决定的,应该还受到了温度、酸碱度、氧含量、腐殖质含量等各种因素的影响。甚至还有一种可能:在靠近池塘的土壤中聚集了一群大量需水且厌氧的微生物,远离池塘的土壤中聚集了一群耐干旱却好氧的微生物,两个不同喜好的微生物群扩张相遇的时候会互相掐架,释放各种生化武器,导致中间地带最不讨好,微生物含量最低。

·特制的 2ml 样品管能高效同步裂解土壤中各种微生物的总 DNA。·特别设计的提取试剂高效去除腐殖酸等 PCR 抑制物。·所需仪器:可适合 2 ml 离心管使用的离心机。 查看产品

添加两种优化的Loading Buffer染料,不遮挡DNA条带荧光的亮度。调点细致调整,每一个片段都足够清晰。 查看产品

·样品用量少,无需稀释,无需比色皿·紫外-可见光全波长扫描(200~850nm)·无需预热,随开随检,速度快,直接显示浓度值·样品的浓度范围是常规紫外-可见分光光度计的50倍·数据统计软件简单容易掌握 查看产品